
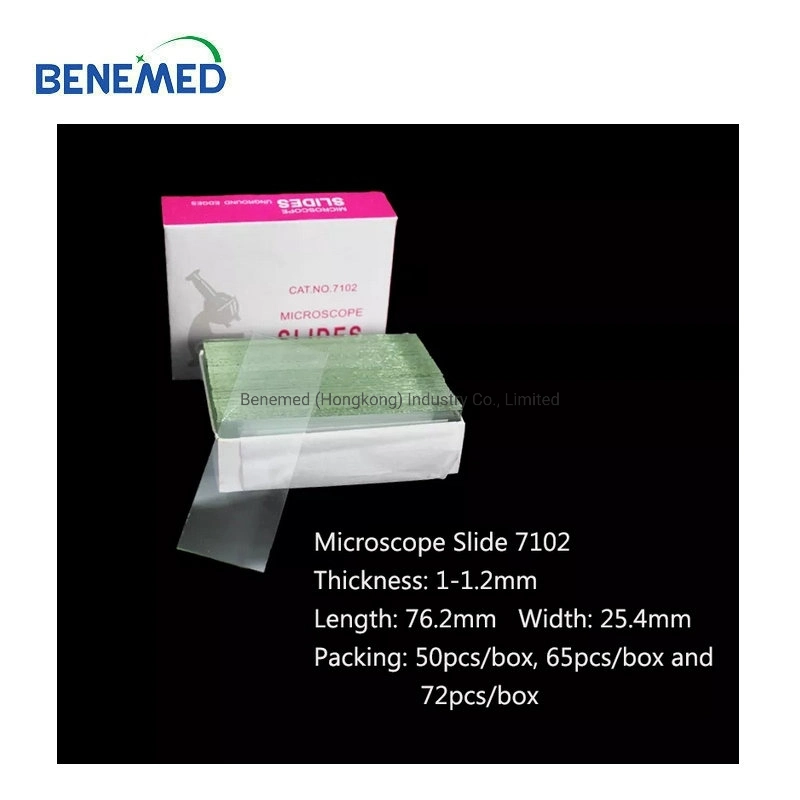
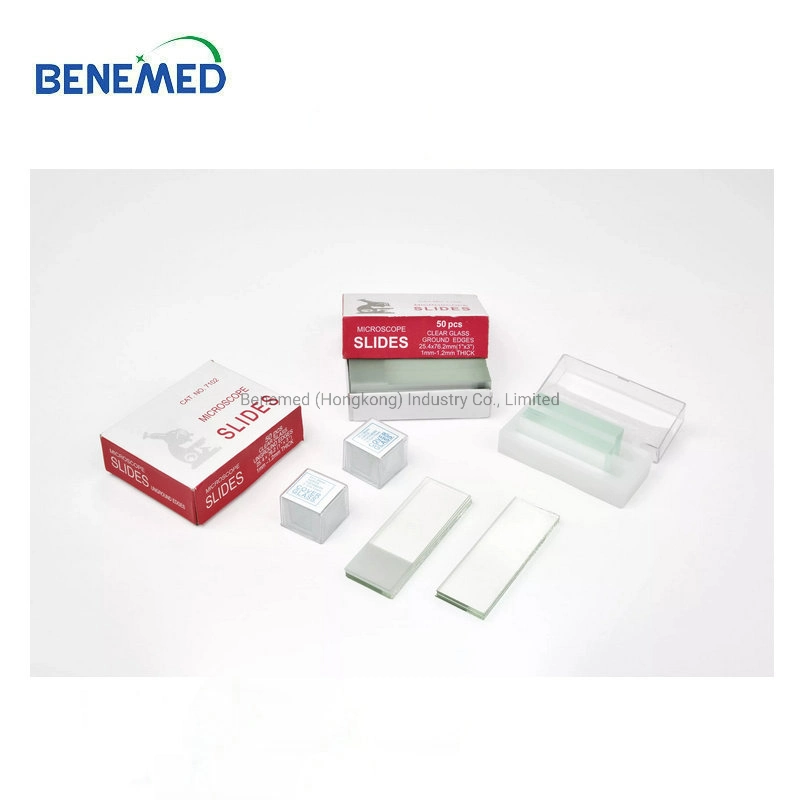
Labor-Einwegartikel, Glaswaren, Glasobjektträger-Abdeckung, Glas-Mikroskop-Objektträger-Slip
Labor-Einwegartikel, Glaswaren, Glasobjektträger-Abdeckung, Glas-Mikroskop-Objektträger-Slip, Verwendung des Glasobjekt
Basisinformation
| Modell Nr. | TYI-7102 |
| Reinigung | Kostenlose Reinigung |
| Material | Sauberes Glas |
| Stil | Auf einer Folie gefrostet |
| Gw | 13kg |
| Transportpaket | 37*18*16 |
| Spezifikation | 25,4*76,2 |
| Warenzeichen | Benemed |
| Herkunft | China |
| HS-Code | 7017200000 |
| Produktionskapazität | 1000000 Stück |
Produktbeschreibung
Labor-Einwegartikel, Glaswaren, Glasobjektträger-Abdeckung, Glas-Mikroskop-Objektträger-Slip| Objektträger aus Glas | ||||||
| Code | Größe (mm) | Stil | Material | Ctn-Größe (cm) | Verpackung | GW(kg) |
| TYI-7101 | 25,4*76,2 | Polierte Kante | Glas | 37*18*16 | 50 Stück, 65 Stück, 72 Stück/Karton, 50 Karton/Karton | 13 |
| TYI-7102 | Schnittkante | |||||
| TYI-7105 | Auf einer Folie mattiert | |||||
| TYI-7107 | Auf der Doppelseite mattiert | |||||
Verwendung des Objektträgers
- Bei der Smear-Methode handelt es sich um eine Methode, bei der das Material gleichmäßig auf dem Objektträger gefilmt wird. Zu den Abstrichmaterialien gehören einzellige Organismen, kleine Algen, Blut, Bakterienkulturflüssigkeit, loses Gewebe von Tieren und Pflanzen, Hoden, Staubbeutel usw. Achten Sie beim Abstrich auf Folgendes: (1) Der Objektträger muss sauber sein. (2) Die Objektträger sollten flach sein. (3) Die Beschichtung muss gleichmäßig sein. Tragen Sie den Tropfen rechts in der Mitte des Objektträgers auf und verteilen Sie ihn gleichmäßig mit einer Skalpellklinge oder einem Zahnstocher. (4) Die Beschichtung sollte dünn sein. Verwenden Sie einen anderen Objektträger als Schieber und schieben Sie ihn vorsichtig von rechts nach links entlang der Oberfläche des Objektträgers mit dem Schmiertropfen (der Winkel zwischen den beiden Objektträgern sollte 30°–45° betragen), um eine dünne Schicht gleichmäßig aufzutragen. (5) Behoben. Zur Fixierung können chemische Fixiermittel oder Trocknungsverfahren (Bakterien) zur Fixierung eingesetzt werden. (6) Färben. Methylenblau wird für Bakterien, Wright-Färbung für Blut und manchmal Jod verwendet. Die Farbstofflösung sollte alle beschichteten Oberflächen bedecken. (7) Spülen. Mit saugfähigem Papier trockentupfen oder trocken backen. (8) Deckglas. Zur Langzeitlagerung mit kanadischem Gummi abdecken.
- Bei der Tablettenpressmethode handelt es sich um eine Tablettierungsmethode, bei der das biologische Material zwischen den Glasobjektträger und das Deckglas gegeben und ein bestimmter Druck ausgeübt wird, um die Gewebezellen zu zerstreuen.
- Bei der Montagemethode handelt es sich um eine Methode zur Versiegelung biologischer Materialien als Ganzes, um Objektträgerproben herzustellen. Mit dieser Methode können temporäre oder dauerhafte Montagen durchgeführt werden. Zu den Befestigungsmaterialien gehören: mikroskopisch kleine Organismen wie Chlamydomonas, Spirogyra, Amöben und Nematoden; Hydra, Blattepidermis von Pflanzen; Flügel, Füße, Mundwerkzeuge von Insekten, menschliche orale Epithelzellen usw.
- Scheiben sind Objektträger, die aus dünnen Scheiben lebender Organismen hergestellt werden. Aufgrund unterschiedlicher Anforderungen kann zum freihändigen Schneiden eine Rasierklinge verwendet werden oder der Gewebeblock in Paraffin oder Kollodium eingebettet oder bei niedriger Temperatur eingefroren und mit einem Mikrotom geschnitten werden. Zur optischen Mikroskopbeobachtung in 5–10 Mikrometer dünne Scheiben schneiden. Ultradünne Schnitte aus in Epoxidharz oder Methacrylsäure eingebetteten Gewebeblöcken mit einer Dicke von 20–50 Nanometern sind speziell für die Beobachtung unter einem Elektronenmikroskop konzipiert. Abschnitte wie Wurzelspitzen und Stängel, die im allgemeinen Unterricht verwendet werden, werden im Allgemeinen als Paraffinabschnitte bezeichnet.
Reinigungsmethode
Waschen Sie es mit Wasser oder Alkohol und wischen Sie es anschließend mit Baumwolle oder Gaze ab (verwenden Sie am besten Linsentuch. Vermeiden Sie es, den Objektträger mit den Fingern zu berühren, um keine Fingerabdrücke darauf zu hinterlassen, die die nächste Beobachtung und Verwendung beeinträchtigen.)



An uns senden






